Sodio (Na) |
Nombre: Sodio
Símbolo Na
Número atómico 11
Peso atómico 22,9898
Descubridor: Humphrey Davy (Inglés)
Año: 1807
Etimología (nombre): del latín sodanum (sosa)
Etimología (símbolo): del latín natrium (nitrato de sodio)

|
| Humphrey Davy |
Propiedades Físicas
Densidad (g/ml) 0,97
Punto de ebullición ºC 892
Punto de fusión ºC 97,8
Masa atómica: 22,98977
Propiedades Electrónicas
Valencia 1
Electronegatividad 0,9
Radio covalente 1,54
Radio iónico (estado de oxidación) 0,95 (+1)
Radio atómico 1,90
Estructura atómica [Ne]3s 1
Potencial primero de ionización (eV) 5,14
Desde el punto de vista comercial, el sodio es el más importante de los metales alcalinos.
El sodio es, después del cloro, el segundo elemento más abundante en solución en el agua de mar.
El sodio (Na) ocupa la posición número 11 en la tabla periódica; tiene 11 protones en su núcleo y 11 electrones en las capas externas alrededor del núcleo.
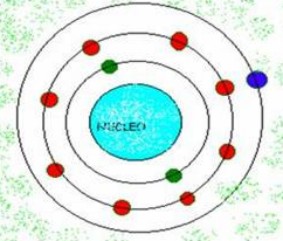
|
| Configuración electrónica del sodio. |
Características
Si bien su existencia ya era conocida, fue obtenido en estado de pureza por primera vez en 1807 por el químico inglés Sir Humphry Davy , mediante el procedimiento de electrolisis del hidróxido sódico.
Humphry Davy, nació el 17 de diciembre de 1778, en Penzance, Cornwall, England, y falleció el 29 de mayo de 1829. Por sus trabajos en ese campo se le conoce como el padre de la electrólisis. Fue uno de los más celebres quíimicos británicos de comienzos del siglo diecinueve. Gracias a sus trabajos en electrólisis fue posible descubrir varios elementos químicos.
Entre ellos el sodio, cuyo nombre procede del latín “sodanum” (soda o sosa) y su símbolo deriva también del latín “natrium” nombre que se aplicaba al nitrato de sodio. (En algunos lugares, para referirse a ciertos compuestos del sodio, se emplea la palabra “soda” , mientras que en España se utiliza el vocablo “sosa” .)
Su color es blanco, plateado
Muy blando
Muy reactivo
Se oxida fácilmente al exponerlo al aire
Reacciona violentamente con el agua formando hidróxido de sodio e hidrógeno
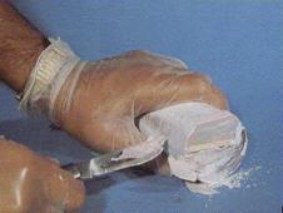
|
| Sodio, metal blando, cortable con cuchillo. |
El sodio solamente se halla en la naturaleza en combinación con otros elementos. Es el séptimo elemento en cuanto a su abundancia en la corteza terrestre y es un componente esencial de los tejidos vegetales y animales.
Las sales de sodio se encuentran en el mar, en lagos salinos, en lagos alcalinos y manantiales minerales bajo la forma de cloruro de socio (NaCl) - la sal marina - disuelto en las aguas, de las que se extrae por evaporación, en forma de cristales.
Aunque es un metal con apariencia similar a la plata algunas de sus propiedades son muy distintas de las que normalmente asociamos a los metales, por ejemplo es tan blando que se corta fácilmente con un cuchillo.
Las sales de sodio más importantes que se encuentran en la naturaleza son el cloruro de sodio (sal de roca), el carbonato de sodio (sosa y trona), el borato de sodio (bórax), el nitrato de sodio (nitrato de Chile) y el sulfato de sodio.
Propiedades
El sodio reacciona con rapidez con el agua, y también con nieve y hielo, para producir hidróxido de sodio e hidrógeno. Cuando se expone al aire, el sodio metálico recién cortado pierde su apariencia plateada y adquiere color gris opaco por la formación de un recubrimiento de óxido de sodio.
El sodio no reacciona con nitrógeno, incluso a temperaturas muy elevadas, pero puede reaccionar con amoniaco para formar amida de sodio.
El sodio y el hidrógeno reaccionan arriba de los 200º C (390º F) para formar el hidruro de sodio. El sodio reacciona difícilmente con el carbono, si es que reacciona, pero sí lo hace con los halógenos. También reacciona con varios halogenuros metálicos para dar el metal y cloruro de sodio.
El sodio no reacciona con los hidrocarburos parafínicos, pero forma compuesto de adición con naftaleno y otros compuestos aromáticos policíclicos y con aril alquenos.

|
| Sodio, sumergido en querosén. |
La reacción del sodio con alcoholes es semejante a la reacción del sodio con agua, pero menos rápida. Hay dos reacciones generales con halogenuros orgánicos. Una de éstas requiere la condensación de dos compuestos orgánicos que contengan halógenos al eliminar éstos. El segundo tipo de reacciones incluye el reemplazo del halógeno por sodio, para obtener un compuesto organosódico.
El sodio, como los restantes metales alcalinos, debido a su gran reactividad al agua, que incluso hace que reaccione con la humedad del aire, en estado puro es necesario conservarlo sumergido en un derivado aceitoso de petróleo, como querosén, aceite lubricante, o vaselina líquida.
En presencia del cloro, basta exponerlo a la luz para que se combine formando cloruro sódico.
Obtención
Su obtención se realiza mediante electrólisis de la fundición de cloruro de sodio (sal) o del hidróxido sódico (soda cáustica).
Las sales de sodio en combustión, dan a la llama un color fuertemente amarillo.
Las sales de sodio cumplen a nivel neurológico una importante función como neurotransmisores. También, conjuntamente con el potasio, el sodio cumple en los procesos vitales una función esencial, al facilitar los procesos osmóticos en las membranas plasmáticas.
Usos y aplicaciones prácticas

|
| Lamparas de sodio. |
Se usa en la fabricación de agentes blanqueantes, en la fabricación del índigo y con frecuencia en las iluminaciones públicas se utilizan lámparas de vapor de sodio fácilmente reconocible por su luz de color amarillento.
La sal común o cloruro de sodio (NaCl), en uno de sus compuestos más familiares, se emplea desde la antigüedad como potenciador del sabor de los alimento y en la conservación de los mismos.
Por se altamente hidrófilos, los compuestos de sodio suelen emplearse como deshumectantes en lugares cerrados, tales como envases de equipos electrónicos o fotográficos, y de algunos medicamentos.
Otro uso industrial, es en la elaboración de combustibles para motores, en la producción de tetraetilo de plomo , que es un elemento antidetonante para evitar que los combustibles gasificados exploten por la compresión, antes del momento debido. Actualmente, por razones ecológicas, el tetraetilo de plomo tiende a ser eliminado de las naftas comunes, para evitar la contaminación plómbica del aire.
Asimismo, el nitrato sódico (NaNO 3 ) se emplea en la elaboración de un medicamento dilatador de los vasos sanguíneos coronarios.

|
El hipoclorito de Sodio es un compuesto químico que contiene cloro en estado de oxidación muy fuerte que posee propiedad desinfectante y muy eficaz para el control bacteriológico y microbiológico, usado por la desinfección, esterilización y decoloración de aguas negras y depósitos y se usa además en concentrados de lodos con olores desagradables, como germicida, desinfectante y desodorante
El bicarbonato sódico o de sodio (NaHCO 3 ), frente al calor, o en presencia de reactivos ácidos, emite gas carbónico, por lo cual es empleado en la fabricación de leudantes (levaduras químicas), en medicamentos efervescentes, y en las bebidas carbonatadas.
El hidróxido de sodio , llamado soda cáustica que se produce tanto en forma sólida como líquida, es ampliamente empleado en la fabricación de papel, en la industria textil; y para el lavado y esterilización de envases reutilizables de vidrio de productos alimenticios, como leche y bebidas refrescantes. También se utiliza en las industrias textil y papelera, el peróxido de sodio (Na 2 O 2 ), como elemento blanqueador.
Fuentes Internet:
http://jmarcano.vr9.com/glosario/glosario_s.html .
http://ciencianet.com/na.html .
http://www.adi.uam.es/docencia/elementos/spv21/sinmarcos/elementos/na.html
http://www.webelements.com/webelements/elements/text/Na/xtal.html

