Lluvia ácida |
¿Qué es la lluvia ácida?
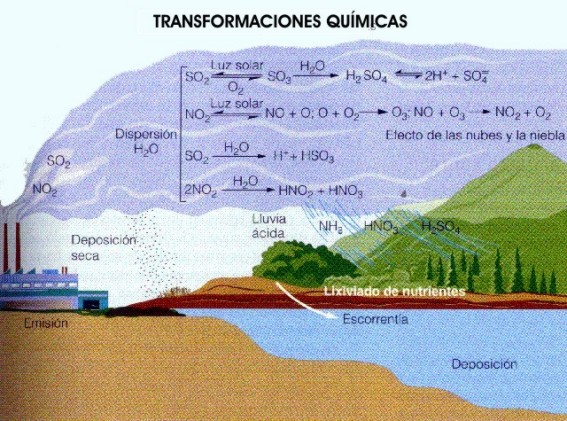
Cuando la atmósfera recibe fuertes dosis de óxidos de azufre y nitrógeno, por reacciones químicas complejas estos compuestos se convierten parcialmente en ácido sulfúrico y nítrico.
|
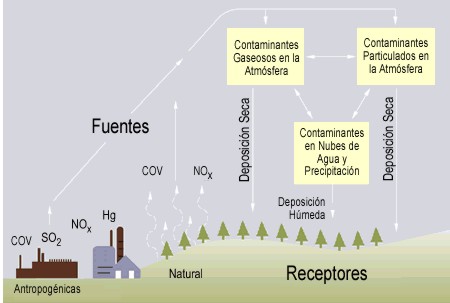
Algunas de esas partículas ácidas desaparecen por gravedad o por impacto contra el suelo, edificios, plantas, etcétera: es la llamada precipitación seca. Otras, permanecen en la atmósfera, se combinan con la humedad de las nubes y caen con la lluvia, la nieve y el rocío: es la lluvia ácida .
El carbón, así como otros combustibles minerales, son los responsables de verter a la atmósfera el óxido de azufre. Las altas temperaturas de las combustiones combinan químicamente el nitrógeno y el oxígeno presentes en el aire y forman el óxido de nitrógeno.
Las centrales eléctricas, las industrias grandes y pequeñas y las casas donde se quema carbón son los responsables, junto a los usuarios de petróleo, de este tipo de contaminación.
El
problema de la lluvia ácida tuvo su origen en
Una extensa área que ha sido objeto de múltiples estudios es el norte de Europa, donde la lluvia ácida ha erosionado estructuras , ha dañado los bosques y las cosechas , y ha puesto en peligro o diezmado la vida en los lagos de agua dulce.
El pH es el símbolo que utiliza la química para medir la acidez o alcalinidad de las soluciones (equivale al logaritmo decimal negativo de la concentración de iones hidrógeno). Una solución neutra tiene un pH de 5,6 a 7 (la escala va de 0,0 a 14,0), por debajo de 5,6 se considera medio ácido y por encima de 7,0, medio alcalino.
La llamada lluvia ácida tiene un pH inferior a 5,6 y puede ir hasta 2,5 y excepcionalmente 1,5.
Una solución con un pH 6 es diez veces más ácida que una de pH 7, una de pH 5, cien veces más ácida, la proporción se va multiplicando por diez a medida que disminuyen los valores del pH.
Los efectos de la lluvia y la precipitación ácida en lagos y corrientes de aguas implica la muerte de crustáceos, insectos acuáticos y moluscos y la desaparición del fitoplancton, lo que provoca con el tiempo la imposibilidad de sobrevivencia del resto de la fauna por falta de alimento y vuelve los lagos transparentes.
|
En el suelo, la acidez penetra en la tierra y afecta las raíces de los árboles, al tiempo que sus hojas se ven afectadas también directamente por las gotas de lluvia que reciben.
El proceso de envenenamiento de la flora termina con la muerte de las plantas y árboles.
Los edificios y las construcciones de hormigón también se ven seriamente afectados, deben ser continuamente restaurados, y en los animales se ha observado pérdida de pelo y desgaste prematuro de mandíbulas entre otras afecciones.
La consecuencia de la lluvia ácida en el ser humano determina un incremento muy importante de las afecciones respiratorias (asma, bronquitis crónica, síndrome de Krupp, etcétera) y un aumento de los casos de cáncer.
La contaminación debilita todo el organismo, sea humano, vegetal o animal, y eso provoca una disminución de las defensas y una mayor disposición a contraer enfermedades.
Los más afectados son los niños, las personas mayores, las mujeres embarazadas y los aquejados de dolencias crónicas como corazón, circulación y asma.
Ver: PSU: Química; Pregun ta 01_2006
Niebla ácida
Si bien la lluvia ácida es dañina para la salud de los humanos, los seres vivos y en general para el ambiente, la neblina ácida parece que la desplazará en importancia y preocupación por los efectos nocivos que tendrá en el ambiente.
Se sabe que la niebla puede contener elevadas concentraciones de sulfatos y nitratos muy ácidos, hasta cien veces más el promedio de la lluvia.
El agua de la niebla es más ácida que el agua de la lluvia debido a que la niebla se forma cerca de la tierra, donde la concentración es mayor. Debido a que las gotitas de agua de la niebla contienen mucha menos agua que las gotas de lluvia, no diluyen la acidez tanto como la lluvia, de ahí que cuando se forma la niebla, sus pequeñas gotas sean altamente ácidas.

|
A medida que crece el tamaño de las gotas la niebla se hace más densa, la acidez se reduce. Cuando la niebla se evapora y se disipa, la acidez aumenta una vez más. En las grandes ciudades se ha descubierto que la niebla es más ácida después de días en que ha habido concentraciones considerables de contaminantes atmosféricos.
Además de los sulfatos y los nitratos, la niebla ácida puede contener rastros de plaguicidas -de acuerdo a los mecanismos de transporte continental de contaminantes-, que en comparación con la concentración de insecticidas organofosforados que se encuentra en la lluvia, éstos tienen una concentración dos a tres veces mayor en la niebla.
Esta elevada concentración de acidez de la niebla ha despertado preocupación con respecto a los daños que puede causar a la vegetación, a los cultivos y a la salud. Los estudios demuestran que la niebla ácida causa daños a la lechuga y aumenta la acidez de los frijoles. También se sospecha que la niebla ácida afecta a los bosques alpinos que frecuentemente están cubiertos de niebla.
En invierno los árboles de los climas septentrionales presentan a menudo niebla helada condensada en contacto con su superficie. Si esta niebla es más ácida que la lluvia, ello podría explicar la muerte periférica de algunos bosques.
Las consecuencias para la salud de la exposición a la neblina ácida son inciertas. Sin embargo, es un hecho que algunos episodios de contaminación atmosférica con aumentos documentados de la mortalidad y la morbilidad se produjeron en tiempos de nieblas. Las gotitas de niebla podrían aumentar los riesgos para la salud si contuvieran y transportaran suficientes contaminantes que afectaran al tórax y a los pulmones.

|
Aun en la actualidad se dispone de poco conocimiento acerca de la niebla ácida en las zonas industriales y se necesitan estudios detallados de la concentración que se deposita en ellas, así como de sus efectos para el medio ambiente y la salud. Con sus resultados se podrían formular medidas para reducir sus efectos.
Ver, además, en Internet:
http://www.tierramerica.net/2000/1015/losabias.shtml
http://www.tecnun.es/Asignaturas/ecologia/Hipertexto/10CAtm1/340DepAc.htm

