Configuración electrónica 001 |
Ejercicios, aplicando la Ley de las Diagonales
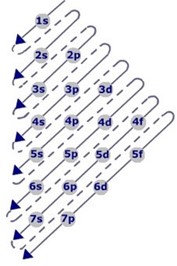
Arriba, un diagrama donde las flechas indican cómo opera la Ley de las Diagonales.
En sentido vertical se enumeran los siete (7) niveles de energía.
En sentido horizontal se anotan los subniveles (s, p, d, f) de energía, y los subíndices indican el número máximo de electrones que soporta cada subnivel.
Veamos algunos ejemplos prácticos:
Desarrollar la estructura electrónica de los elementos Calcio, Bromo, Oxígeno, Oro, Plomo, Criptón, Galio y Fósforo.
Primero que todo, debes conocer el número atómico de cada elemento:
Calcio:
Número atómico: 20 porque tiene 20 protones y 20 electrones.
Ahora, para anotar o escribir su configuración o estructura electrónica, usamos el cuadro de las diagonales:
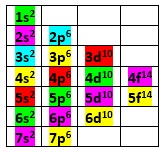
Seguimos los colores, en forma diagonal, para anotar la configuración de cada elemento.
Su configuración es ![]()
Si sumas los subíndices te da 20, el número de electrones.
4s2 significa que en este subnivel tiene 2 electrones.
Bromo:
Número atómico: 35 porque tiene 35 protones y 35 electrones
Su configuración es ![]()
4p5 significa que en este subnivel tiene 5 electrones (Subnivel que puede tener máximo 6 electrones).
Oxígeno:
Número atómico: 8 porque tiene 8 protones y 8 electrones
Su configuración es ![]()
Sumados los subíndices da 8, el número de electrones del oxígeno
2p4 significa que en su última capa tiene 4 electrones
Oro:
Número atómico: 79
Su configuración es
Sumados los subíndices da 79, el número de electrones del oro.
5d9 significa que en su última capa tiene 9 electrones.
Plomo:
Su número atómico es 82
Su configuración es
![]()
Criptón:
Su número atómico es 36
Su configuración es ![]()
Galio:
Su número atómico es 31
Su configuración es ![]()
Fósforo:
Su número atómico es 15
Su configuración es ![]()

