Enlace químico |
En química, un dato experimental importante es que sólo los gases nobles y los metales en estado de vapor se presentan en la naturaleza como átomos aislados , en la mayoría de los materiales que nos rodean los elementos están unidos por enlaces químicos .
Enlace significa unión, un enlace químico es la unión de dos o más átomos con un solo fin, alcanzar la estabilidad, tratar de parecerse al gas noble más cercano. Para la mayoría de los elementos se trata de completar ocho electrones en su último nivel.
Molécula de H 2 |
|
|
Las fuerzas atractivas que mantienen juntos los elementos que conforman un compuesto, se explican por la interacción de los electrones que ocupan los orbitales más exteriores de ellos (electrones de valencia) .
Cuando dos átomos se acercan se ejercen varias fuerzas entre ellos. Algunas de estas fuerzas tratan de mantenerlos unidos, otras tienden a separarlos.
En la mayoría de los átomos, con excepción de los gases nobles (muy estables, con su última capa o nivel de energía completo con sus ocho electrones), las fuerzas atractivas son superiores a las repulsivas y los átomos se acercan formando un enlace .
Así, podemos considerar al enlace químico como la fuerza que mantiene unidos a dos o más átomos dentro de una molécula .
Todos los enlaces químicos resultan de la atracción simultánea de uno o más electrones por más de un núcleo.
Electrones de Valencia
Ya que arriba lo mencionamos, veamos este concepto.
En la mayoría de los átomos, muchos de los electrones son atraídos con tal fuerza por sus propios núcleos que no pueden interaccionar de forma apreciable con otros núcleos. Sólo los electrones que ocupan los niveles de energía más alejados del núcleo de un átomo pueden interaccionar con dos o más núcleos. A éstos se les llama electrones de valencia (sobre los niveles de energía Ver: Configuración electrónica ) .
La unión consiste en que uno o más electrones de valencia de algunos de los átomos se introduce en la esfera electrónica del otro.
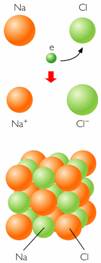
|
| La ilustración describe cristales de Cloruro de sodio (enlace químico iónico). |
Aquí debemos recordar que el número de electrones de valencia de un átomo es igual al número de su familia o grupo (que corresponden a las 18 divisiones verticales) en la tabla periódica , usando sólo la antigua numeración romana.
Así, tenemos un electrón de valencia para los elementos de los grupos IA (o grupo 1) y IB (o grupo 11); dos electrones de valencia para los elementos de los grupos IIA y IIB (o grupos 2 y 12), y cuatro para los elementos de los grupos IVB y IVA (o grupos 4 y 14).
Ver: Tabla Periódica de los Elementos .
Todos los átomos de los gases nobles (o sea: neón, argón, criptón, xenón y radón) tienen ocho electrones de valencia, excepto el helio, que tiene dos. Los elementos de las familias (grupos) cercanas a los gases nobles tienden a reaccionar para adquirir la configuración de ocho electrones de valencia de los gases nobles.
Esta configuración electrónica de los gases nobles les comunica inactividad química y una gran estabilidad.
Esto se conoce como la regla del octeto de Lewis , que fue enunciada por el químico estadounidense Gilbert N. Lewis.
Regla del octeto
Los átomos tienden a perder, ganar o compartir electrones en forma tal que queden con un total de 8 electrones en su nivel energético más exterior, esta configuración les proporciona gran estabilidad.
Estructura o Notación de Lewis
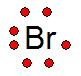
|
La notación o estructura de Lewis es una representación gráfica que muestra la cantidad de electrones de valencia que hay en el último orbital.
La estructura de Lewis fue propuesta por Gilbert Lewis, la cantidad de electrones de valencia se representan con puntos alrededor del elemento químico (símbolo), como vemos a la derecha en el ejemplo del Br.
Ver en Youtube:
http://ampliacionfq3eso.blogspot.com/2009/02/enlace-covalente-notacion-de-lewis.html
Valencia electroquímica
Se llama valencia electroquímica al número de electrones que ha perdido o ganado un átomo para transformarse en ion. Si dicho número de electrones perdidos o ganados es 1, 2, 3, etcétera, se dice que el ion (o ión) es monovalente, bivalente, trivalente, etcétera.
Iones
Los átomos están constituidos por el núcleo y la corteza (capas o niveles de energía que ocupan los electrones). El número de cargas positivas (cantidad de protones) del núcleo es igual al número de electrones que giran en la corteza; de ahí su electronegatividad (que en estado neutro es cero , y significa igual cantidad de protones a igual cantidad de electrones). Si la corteza electrónica de un átomo neutro pierde o gana electrones se forman los llamados iones.
Entonces, los iones son átomos o grupos atómicos que tienen un número mayor o menor de electrones que de protones.
En el primer caso (más electrones) los iones tienen carga negativa y reciben el nombre de aniones , y en el segundo (menos electrones) están cargados positivamente y se llaman cationes .
Ver: PSU: Química; Pregunta 06_2006
Elementos electropositivos y electronegativos
Se llaman elementos electropositivos aquellos que tienen tendencia a perder electrones transformándose en cationes ; a ese grupo pertenecen los metales .
En cambio, elementos electronegativos son los que toman con facilidad electrones transformándose en aniones ; a este grupo pertenecen los metaloides .
Los elementos más electropositivos (tendencia a perder electrones) están situados en la parte izquierda del sistema o tabla periódica ; son los llamados elementos alcalinos . A medida que se avanza en cada período hacia la derecha va disminuyendo el carácter electropositivo, llegándose, finalmente, a los alógenos de fuerte carácter electronegativo (elementos con tendencia a tomar electrones).
A modo de resumen:Ion : átomo o conjunto de átomos que poseen carga eléctrica (han cedido o han captado electrones). Catión: ion con carga positiva (ha cedido electrones). Ejemplo: Ca+2 ion calcio, NH4+ ion amonio Anión: ion con carga negativa (ha captado electrones). Ejemplo: Br– ion bromuro, ClO2– ion clorito |
EJEMPLOS:
El sodio tiene un potencial de ionización bajo y puede perder fácilmente su electrón ubicado en el
subnivel 3s
| Na 0 |
→ |
Na+ |
+ |
1e– |
|
1s 2 2s 2 2p 6 3s 1 |
→ |
1s 2 2s 2 2p 6 |
+ |
1e– |
|
átomo de sodio |
|
ion de sodio |
|
|
La estructura electrónica del ion sodio resultante es exactamente igual a la del gas noble neón. Este ion es una especie muy estable.
Otros elementos ganan electrones para llenar la capa de valencia y alcanzar la configuración estable de 8 electrones. El cloro es un ejemplo:
| Cl 0 |
→ |
1e– |
+ |
Cl– |
|
1s 2 2s 2 2p 6 3s 2 3p 5 |
→ |
|
+ |
1s 2 2s 2 2p 6 3s 2 3p 6 |
|
átomo de cloro |
|
|
|
ion cloruro |
Tipos de enlaces
Como dijimos al principio, el hecho de que los átomos se combinen o enlacen para formar nuevas sustancias se explica por la tendencia a conformar estructuras más estables. De ahí que dichos enlaces químicos sean considerados como un incremento de estabilidad.
Para lograr ese estado ideal estable, los átomos pueden utilizar algún método que les acomode, eligiendo entre: ceder o captar electrones, compartir electrones con otro átomo o ponerlos en común junto con otros muchos.
De estas tres posibilidades nacen los tres tipos de enlace químico: iónico , covalente y metálico .
Tomando como base la diferencia de electronegatividad entre los átomos que forman un enlace se puede predecir el tipo de enlace que se formará:
| Si la diferencia de electronegatividades es mayor que 2. |
= |
se formará un enlace iónico |
|
Si la diferencia de electronegatividades es mayor que 0,5 y menor a 2,0. |
= |
el enlace formado será covalente polar |
|
Si la diferencia de electronegatividades es menor a 0,5 |
= |
el enlace será covalente puro (o no polar). |
Enlace iónico
Cuando una molécula de una sustancia contiene átomos de metales y no metales , los electrones son atraídos con más fuerza por los no metales, que se transforman en iones con carga negativa; los metales, a su vez, se convierten en iones con carga positiva.
Entonces, los iones de diferente signo se atraen electrostáticamente, formando enlaces iónicos.
Este enlace se origina cuando se transfiere uno o varios electrones de un átomo a otro. Debido al intercambio electrónico, los átomos se cargan positiva y negativamente, estableciéndose así una fuerza de atracción electrostática que los enlaza. Se forma entre dos átomos con una apreciable diferencia de electronegatividades , los elementos de los grupos I y II A forman enlaces iónicos con los elementos de los grupos VI y VII A.
Enlace iónico: Molécula de NaCl |
|
|
En general, cuando el compuesto está constituido por un metal y un no-metal y además la diferencia en electronegatividades es grande, el compuesto es iónico . Es el caso del bromuro de potasio (KBr).
(Ver: PSU: Química, Pregunta 04_2005 ).
Propiedades de un enlace iónico
Los productos resultantes de un enlace iónico poseen características especiales:
• Son sólidos de elevado punto de fusión y ebullición.
• La mayoría son solubles en disolventes polares como el agua.
• La mayoría son insolubles en disolventes apolares como el benceno o el hexano.
• Las sustancias iónicas conducen la electricidad cuando están en estado líquido o en disoluciones acuosas por estar formados por partículas cargadas (iones), pero no en estado cristalino, porque los iones individuales son demasiado grandes para moverse libremente a través del cristal.
• Al intentar deformarlos se rompe el cristal, son frágiles.
Enlace covalente
Se presenta cuando se comparten uno o más pares de electrones entre dos átomos cuya diferencia de electronegatividad es pequeña.
Ver: PSU: Química; Pregunta 04_2005(Química2)
Enlace covalente apolar (o no polar)
Si los átomos enlazados son no metales e idénticos (como en N 2 o en O 2 ), los electrones son compartidos por igual por los dos átomos, y el enlace se llama covalente apolar .
Se establece entre átomos con igual electronegatividad. Átomos del mismo elemento presentan este tipo de enlace.
Enlace covalente apolar: Molécula de N 2(Usando la Notación de Lewis) |
|
|
Ver: PSU: Química; Pregunta 09_2006
En este enlace covalente no polar, la densidad electrónica es simétrica con respecto a un plano perpendicular a la línea entre los dos núcleos. Esto es cierto para todas las moléculas diatómicas homonucleares (formadas por dos átomos del mismo elemento) , tales como H 2 , O 2 , N 2 , F 2 y Cl 2 , porque los dos átomos idénticos tienen electronegatividades idénticas. Por lo que podemos decir: los enlaces covalentes en todas las moléculas diatómicas homonucleares deben ser no polares . Por ejemplo, una molécula de dióxido de carbono (CO 2 ) es lineal con el átomo de carbono al centro y, por lo tanto, debido a su simetría es covalente apolar.
(Ver: PSU: Química, Pregunta 04_2005 ).
Enlace covalente polar
Si los átomos son no metales pero distintos (como en el óxido nítrico, NO), los electrones son compartidos en forma desigual y el enlace se llama covalente polar (polar porque la molécula tiene un polo eléctrico positivo y otro negativo, y covalente porque los átomos comparten los electrones, aunque sea en forma desigual).
Se establece entre átomos con electronegatividades próximas pero no iguales.
Estas sustancias no conducen la electricidad ni tienen brillo, ductilidad o maleabilidad.
Veamos un ejemplo:
¿Qué tipo de enlace se formará entre H y O?
Según la Tabla de Electronegatividades de Pauli , el Hidrógeno tiene una electronegatividad de 2,2 y el Oxígeno 3,44 , por lo tanto la diferencia de electronegatividades será: 3,44 – 2,2 = 1,24.
El resultado de la operación entrega 1,24 cifra que es menor que 2,0 y mayor que 0,5.
Por lo tanto, el enlace será covalente polar . Además, si no se conociera la electronegatividad de los elementos bastaría saber que son dos no metales distintos para definir su enlace como covalente polar.
Enlace covalente coordinado
Se establece por compartición de electrones entre dos átomos, pero sólo un átomo aporta el par de electrones compartidos.
Ver: PSU: Química, Pregunta 08_2006
Propiedades de los enlaces covalentes
• Son gases, líquidos o sólidos de bajo punto de fusión.
• La mayoría son insolubles en disolventes polares.
• La mayoría son solubles en disolventes apolares.
• Los líquidos y sólidos fundidos no conducen la electricidad.
• Las disoluciones acuosas son malas conductoras de la electricidad porque no contienen partículas cargadas.
Enlace metálico
Si los átomos enlazados son elementos metálicos, el enlace se llama metálico . Los electrones son compartidos por los átomos, pero pueden moverse a través del sólido proporcionando conductividad térmica y eléctrica, brillo, maleabilidad y ductilidad.
Los electrones que participan en él se mueven libremente, a causa de la poca fuerza de atracción del núcleo sobre los electrones de su periferia.
Cuando los electrones son compartidos simétricamente, el enlace puede ser metálico o covalente apolar; si son compartidos asimétricamente, el enlace es covalente polar; la transferencia de electrones proporciona enlace iónico. Generalmente, la tendencia a una distribución desigual de los electrones entre un par de átomos aumenta cuanto más separados están en la tabla periódica .
Cómo se forman los enlaces covalentes no polares y polares
Al contrario de los enlaces iónicos, en los cuales ocurre una transferencia completa de electrones, el enlace covalente ocurre cuando dos (o más) elementos comparten electrones.
El enlace covalente ocurre porque los átomos en el compuesto tienen una tendencia similar hacia los electrones (generalmente para ganar electrones). Esto ocurre comúnmente cuando dos no metales se enlazan. Ya que ninguno de los no metales que participan en el enlace querrá ganar electrones, estos elementos compartirán electrones para poder llenar sus envolturas de valencia.
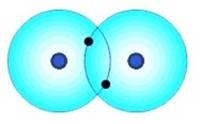
Un buen ejemplo de un enlace covalente es ese que ocurre entre dos átomos de hidrógeno.
Los átomos de hidrógeno (H) tienen un electrón de valencia en su primera y única capa o envoltura. Puesto que la capacidad de esta envoltura es de dos electrones, cada átomo hidrógeno tenderá a captar un segundo electrón.
Enlace covalente apolar entre dos átomos de hidrógeno (H) |
|
|
En un esfuerzo por recoger un segundo electrón, el átomo de hidrógeno reaccionará con átomos H vecinos para formar el compuesto H 2 . Ya que el compuesto de hidrógeno es una combinación de átomos igualados, los átomos compartirán cada uno de sus electrones individuales, formando así un enlace covalente. De esta manera, ambos átomos comparten la estabilidad de una envoltura de valencia.
Siempre que dos átomos del mismo elemento se enlazan (formando moléculas diatómicas homonucleares), tendremos un enlace no polar.
Otro ejemplo de enlace covalente apolar (no polar), pero con átomos diferentes, es el metano (CH 4 ).
La electronegatividad del carbono es 2,5 y la del hidrógeno es 2,1; la diferencia entre ellos es de 0,4 (menor de 0,5), por lo que el enlace se considera no polar. Además, el metano es una molécula muy simétrica, por lo que las pequeñas diferencias de electronegatividad en sus cuatro enlaces se anulan entre sí.
En cambio, se forma un enlace polar cuando los electrones son desigualmente compartidos (permanecen más tiempo cerca de un átomo que del otro) entre dos átomos. Los enlaces covalentes polares ocurren porque un átomo tiene una mayor afinidad hacia los electrones que el otro (sin embargo, no tanta como para empujar completamente los electrones y formar un ión).
Esto quiere decir que, en un enlace covalente polar los electrones que se enlazan pasarán un mayor tiempo alrededor del átomo que tiene la mayor afinidad hacia los electrones. Un buen ejemplo del enlace covalente polar es el enlace hidrógeno - oxígeno en la molécula de agua.
Fuentes Internet:
http://www.fisicanet.com.ar/quimica/uniones/ap02_enlaces.php
http://www.cespro.com/Materias/MatContenidos/Contquimica/QUIMICA_INORGANICA/enlace_quimico.htm
http://www.monografias.com/trabajos7/enqui/enqui.shtml


 1s
1
1s
1
1s
1
1s
1
