Óxido-reducción (Ecuaciones redox) |
Definición
Una reacción de óxido-reducción se caracteriza porque hay una transferencia de electrones , en donde una sustancia gana electrones y otra sustancia pierde electrones:
• la sustancia que gana electrones disminuye su número de oxidación . Este proceso se llama Reducción .
• la sustancia que pierde electrones aumenta su número de oxidación. Este proceso se llama Oxidación.
Por lo tanto, la Reducción es ganancia de electrones y la Oxidación es una pérdida de electrones.
(Ver: PSU: Química; Pregunta 08_2005 (Química2)
Corresponde a la carga del elemento químico; es decir, corresponde a un valor arbitrario que se le ha asignado a cada elemento químico, el cual indica la cantidad de electrones que podría ganar, perder o compartir cuando se forma un compuesto.
(Ver: PSU: Química, Pregunta 02_2005 )
Para calcular el número de oxidación se deben tener en cuenta las siguientes reglas:
Regla Nº 1 : El número de oxidación de cualquier átomo en estado libre o fundamental; es decir, no combinado, es cero .
Ejemplos: Pt , Cu, Au, Fe
Regla Nº 2: El número de oxidación del hidrógeno es +l , excepto en el caso de los hidruros que es –1 .
+ 1: cuando el hidrógeno se combina con un no-metal (ácido).
Ejemplos: HCl; ácido clorhídrico
número de oxidación del hidrógeno: + 1
número de oxidación del cloro: – 1
HI; ácido yodhídrico
número de oxidación del hidrógeno: + 1
número de oxidación del cloro: – 1
– 1: cuando el hidrógeno se combina con un metal (hidruros)
Ejemplos : NaH; hidruro de sodio
número de oxidación del hidrógeno: - 1
número de oxidación del sodio: + 1
LiH; hidruro de litio
número de oxidación del hidrógeno: - 1
número de oxidación del litio: + 1
Regla Nº 3: El número de oxidación del oxígeno es -2 , excepto en los peróxido donde es -1 .
Ejemplos: CaO; óxido de calcio
número de oxidación del oxígeno: - 2
número de oxidación del calcio: + 2
H 2 O 2 ; peróxido de hidrógeno o agua oxigenada
número de oxidación del oxígeno: - 1
número de oxidación del hidrógeno: + 1
Regla Nº 4: Los metales tienen un número de oxidación + (positivo) e igual a su valencia .
Ejemplos : Ca (calcio): valencia = 2
número de oxidación: + 2
Li (litio): valencia = 1
número de oxidación: + 1
Regla Nº 5: Los no-metales tienen número de oxidación – (negativo) e igual a su valencia .
Ejemplos: Cl (cloro): valencia = 1
número de oxidación: – 1
I (yodo): valencia = 1
número de oxidación: –1
Regla Nº 6: En compuestos, el número de oxidación del Flúor ( F) es siempre –1 .
Ejemplo. NaF: fluoruro de sodio
número de oxidación del flúor: – 1
número de oxidación del sodio: + 1
Regla Nº 7: En las moléculas neutras , la suma de los números de oxidación de cada uno de los átomos que la forman es igual a 0.
Ejemplos: Cu 2 O: óxido cuproso
número de oxidación del cobre: + 1; como hay dos átomos de cobre, se multiplica el número de oxidación por el número de átomos de la molécula: 2 • + 1= + 2.
número de oxidación del oxígeno: – 2
+ 2 + – 2 = 0
H 2 SO 4 : ácido sulfúrico
número de oxidación del hidrógeno: + 1; hay 2 átomos = 2 · + 1 = + 2
número de oxidación del azufre: + 6; hay 1 átomo = 1 · + 6 = + 6
número de oxidación del oxígeno: – 2, hay 4 átomos = 4 · – 2 = – 8
+ 2 + + 6 + – 8 = 0
Regla Nº 8: En un ión la suma de los números de oxidación de sus átomos debe ser igual a la carga del ión.
Ejemplo: PO 4 –3 : fosfato
número de oxidación del fósforo: + 5; hay 1 átomo = 1 • + 5 = + 5
número de oxidación del oxígeno: –2; hay 4 átomos = 4 • – 2 = – 8
La molécula tiene una carga de – 3, por lo tanto, al sumar los números de oxidación del fósforo y del oxígeno, el resultado debe ser igual a – 3.
+ 5 + – 8 = – 3
– 3 = – 3
Concepto de oxidación- reducción:

|
Cuando se introduce una lámina de zinc (Zn) en una disolución concentrada de cobre II (Cu ; valencia = 2), transcurridos unos segundos, se observa que la lámina se recubre de una capa de cobre metálico.
La ecuación química que representa este proceso es:
Zn + CuSO 4 —> Cu + ZnSO 4
El sulfato de cobre (II), CuSO 4, y el sulfato de zinc, ZnSO 4 , son compuestos que, fundidos o disueltos en agua, se disocian en iones, según la siguiente ecuación iónica:
Zn 0 + Cu + 2 + SO 4 – 2 —> Cu 0 + Zn + 2 + SO 4 – 2
En esta ecuación puede apreciarse que el ión sulfato (SO -2 ) aparece en ambos lados de la ecuación, por lo tanto, la ecuación puede escribirse de manera más sencilla :
Cu + 2 + Zn 0 —> Cu 0 + Zn + 2
La ecuación química nos indica que durante el proceso el átomo de zinc, que era eléctricamente neutro, se ha transformado en el ión Zn +2 . Para esto, tuvo que ceder 2 electrones; en cambio, el ión Cu +2 aceptó los 2 electrones del zinc, que lo convirtieron en un átomo de cobre, eléctricamente neutro.
De acuerdo a este hecho experimental, se puede concluir que:
• la sustancia que pierde electrones hace que la otra sustancia gane electrones; es decir, la sustancia que se oxida hace que la otra sustancia se reduzca . Por esto se dice que la sustancia que se oxida es el Agente Reductor, y la sustancia que se reduce es el Agente Oxidante.
• como los electrones son cargas negativas, cuando una sustancia gana electrones; es decir, se reduce, se vuelve más negativa, por lo que disminuye su número de oxidación. Por el contrario, cuando una sustancia pierde electrones , se vuelve más positiva, por lo que aumenta su número de oxidación.
Ejemplo: Zn 0 + Cu +2 —> Zn +2 + Cu +0
Esta es una reacción de óxido-reducción porque hay una transferencia de electrones, pues los números de oxidación del Zn y Cu, al comienzo de la reacción, no son los mismos al final de la reacción.
El Zn cambia su número de oxidación de 0 a +2; esto significa un aumento del número de oxidación, por lo tanto, hay una pérdida de electrones (2 electrones); el Fe es agente reductor.
El Cu cambia su número de oxidación de +2 a 0; esto significa una disminución del número de oxidación, por lo tanto, hay una ganancia de electrones (2 electrones); el Cu es agente oxidante.
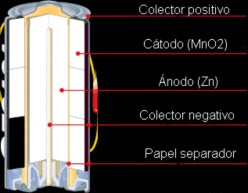
|
| Esquema de una pila alcalina. |
Esta reacción química entre el zinc y el sulfato de cobre se utiliza para obtener corriente eléctrica . Para ello es necesario diseñar un dispositivo que permita que la reacción se desarrolle en dos partes físicamente separadas: una parte donde se generan los electrones (por la oxidación del Zn), y otra, en la que se reciben (por la reducción del Cu +2 ). Si conectamos ambas partes con un alambre, el movimiento de los electrones a través de él generará una corriente eléctrica.
Semi-reacciones de óxido-reducción:
De acuerdo a lo anterior, puede decirse que la reacción química descrita anteriormente involucra dos procesos, los cuales pueden representarse mediante semi-reacciones, una semi -reacción de oxidación y una semi-reacción de reducción. Como estos dos procesos ocurren simultáneamente, la suma de ambas semi-reacciones, da la reacción total.
Las ecuaciones que describen estos procesos son:
Semi-reacción de oxidación :
Zn —> Zn +2 + 2e –
Semi-reacción de reducción :
Cu +2 + 2e – —> Cu
|
Por lo tanto, en el proceso de oxidación un átomo o ión cede uno o más electrones; mientras que en el de reducción, el átomo o ión capta uno o más electrones. Ambos procesos son complementarios y ocurren simultáneamente. De ahí el nombre de reacciones redox. En los procesos de óxido-reducción, la transferencia de electrones siempre ocurre desde un agente reductor a un agente oxidante. |
|
Átomo o ión que se: |
|
|
Oxida |
Reduce |
|
Cede electrones Aumenta su número de oxidación Es un agente reductor |
Acepta electrones Disminuye su número de oxidación Es un agente oxidante |
Para escribir las semi-reacciones siempre se debe considerar lo siguiente:
1. se debe igualar cada semi-reacción en cuanto a átomos (balance de masa) y en cuanto a carga (balance de cargas)
2. al escribir las semi-reacciones y equilibrar las cargas, se deben agregar electrones a la derecha en la oxidación (hay pérdida de electrones) y a la izquierda en la reducción (hay ganancia de electrones).
3. como en la ecuación total no aparecen electrones, se debe multiplicar cada semi-reacción, si fuese necesario, por un número que permita igualar los electrones de la derecha con los electrones de la izquierda, a fin de que se simplifiquen.
4. Sumar las semi-reacciones y comprobar que los átomos y las cargas estén equilibradas a ambos lados de la ecuación.
Volviendo al ejemplo anterior:
Zn 0 + Cu +2 + SO 4 -2 —> Cu 0 + Zn +2 + SO 4 –2
Como los átomos que participan en la reacción son sólo el Zn y el Cu, se anota la ecuación química en forma más simple:
Zn 0 + Cu +2 —> Zn +2 + Cu +0
Se plantean las semi-reacciones:
Semi-reacción de oxidación:
Zn —> Zn +2 + 2e –
Semi-reacción de reducción:
Cu +2 + 2e – —> Cu
Sumando ambas semi-reacciones se tiene:
Zn —> Zn +2 + 2e –
+ Cu +2 + 2e – —> Cu
--------------------------------------------------------------------------
Zn 0 + Cu +2 —> Zn +2 + Cu +0
(Ver: PSU: Química, Pregunta 10_2005 )
Ir a: Ejercicio explicativo sobre la forma de balancear la ecuación de una reacción de óxido reduccción con el método Redox
Aplicaciones de la oxidación-reducción
Las reacciones de oxidación-reducción son muy frecuentes en la industria ya que constituyen el principio de funcionamiento de las pilas eléctricas , tales como las pilas alcalinas y se emplean para refinar electroquímicamente determinados metales, tales como el cobre en nuestro país. También se utilizan para la protección de los metales contra la corrosión. En la naturaleza, intervienen en la respiración celular y en la fotosíntesis .
Fuentes:
Ciencias Químicas II y IV. Educación Media. Santillana
Enciclopedia Encarta
Curso Universitario de Química. BruceMahan
II Curso de Química General. Francisco Santamaría

