Digestión de proteínas o digestión proteica |
Por su gran tamaño molecular, las proteínas aportadas por la dieta no pueden ser absorbidas directamente en el proceso de la digestión. Para hacerlo, deben ser descompuestas en sus amioácidos constituyentes, tarea que realizan las enzimas proteolíticas (que degradan proteínas) producidas en el estómago , en el páncreas y en el intestino delgado .
Digestión de proteínas en el estómago
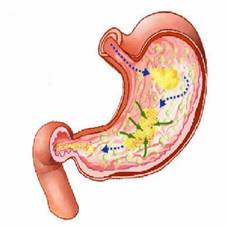
La digestión de proteínas se inicia en el estómago gracias a la acción conjunta del ácido clorhídrico y de la pepsina .

|
| Aportadores de proteínas. |
El ácido clorhídrico se sintetiza en las células parietales del estómago y tiene como funciones matar algunas bacterias, desnaturalizar a las proteínas y activar el pepsinógeno para convertirlo en pepsina y así iniciar la hidrólisis enzimática proteica.
|
| Acción del ácido clorhídrico y de la pepsina. |
El pepsinógeno es un zimógeno o proenzima (precursor enzimático inactivo; es decir, no cataliza ninguna reacción como hacen las enzimas ) que para activarse necesita de un cambio bioquímico en su estructura . El ácido clorhídrico se encarga de hacerlo y así el zimógeno se convierte en una enzima activa, la pepsina.
Ver: PSU: Biología; Pregunta 12_2006(2)
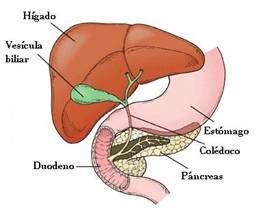
Digestión proteica por enzimas pancreáticas
Al llegar al intestino delgado, los péptidos que se producen en el estómago por acción de la pepsina son fragmentados a oligopéptidos y aminoácidos libres por acción de las proteasas de origen pancreático: la tripsina, la quimotripsina, la elastasa y las carboxipeptidasas A y B.
Tripsina
La tripsina al igual de la pepsina puede ejercer un efecto autocatalítico generando más moléculas de tripsina.
Quimotripsina
|
| Páncreas, otro agente importante para la digestión proteica. |
Se secreta como zimógeno y se activa por acción de la tripsina. Reconoce y corta específicamente triptófano, tirosina, fenilalanina, metionina y leucina en el extremo carbonilo de la unión peptídica.
Elastasa
Se secreta como zimógeno o proelastasa, se activa por la tripsina y reconoce alanina, glicina y serina en el extremo carbonilo de la unión peptídica.
Carboxipeptidasas A y B
Son exopeptidasas que se secretan como procarboxipeptidasas A y B y se activan por acción de la tripsina, la carboxipeptidasa A reconoce casi todos aminoácidos en el extremo C-terminal.
Digestión intestinal
|
| Intestinos, la absorción final. |
La superficie luminal del intestino contiene una aminopeptidasa, exopeptidasa , que degrada repetidamente el residuo N-terminal de los oligopéptidos para producir aminoácidos libres y péptidos de tamaño pequeño.
Absorción de aminoácidos y dipéptidos
Las células epiteliales del intestino absorben aminoácidos libres mediante un mecanismo de transporte activo secundario acoplado al transporte de sodio.
También se pueden absorber pequeños péptidos mediante pinocitosis .
En el citosol del enterocito todos los oligopéptidos se terminan de hidrolizar de forma tal que solo pasan aminoácidos a la vena porta.
Fuente Interrnet:

