PSU: Química |
Pregunta 11_2006
¿Cuántos moles de N 2 hay en 44,8 litros de este gas medidos a 0º C y a 1 atm de presión?
A) 0,5 mol
B) 1,0 mol
C) 1,5 mol
D) 2,0 moles
E) 4,0 moles
Eje temático: Disoluciones químicas.
Contenido: Volumen molar de un gas.
Curso: Segundo medio
Clave: D
Comentario
Es una pregunta muy directa sobre la cantidad de un gas bajo las condiciones dadas de presión y temperatura .
En la Enseñanza Media se utiliza mucho el concepto de volumen molar de un gas (ideal en condiciones normales de presión y temperatura, 1 atm y 0º C). Este volumen en estas condiciones es de 22,4 litros. Luego, si un mol ocupa 22,4 litros, el doble de este volumen debe contener 2,0 moles de gas, que corresponde a la alternativa D .
Pero existe una manera un poco más compleja, que considera la ecuación de los gases ideales .
![]()
Donde n es el número de moles, P la presión en atm, V el volumen de gas en litros, R la constante de los gases (0,082 L atm/K mol) y T la temperatura en grados Kelvin (esta se calcula sumando 273 a la temperatura en grados Celsius conocida), que en este caso es 273 + 0 = 273. Luego, la cantidad de moles será:
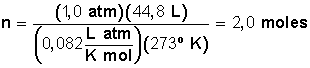
Parece claro que este procedimiento, que manejan algunos estudiantes, no es apropiado en la PSU debido a que su resolución sin calculadora es muy lento.
Sin embargo, igual llama la atención que hubo una omisión del 70 por ciento, y solo respondió correctamente el 15 por ciento de los postulantes.
Es probable que algunos estudiantes manejen el concepto del volumen molar de un gas de 22,4 L como una constante inmutable, olvidando que esto se cumple sólo si se tiene 1 mol de gas ideal a la presión de 1,0 atm y a 273º K.
Fuente Internet:
Publicación oficial del Demre en www.demre.cl

