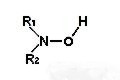
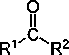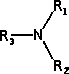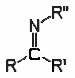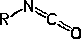Grupos funcionales |
Para comprender lo que son o significan los grupos funcionales es necesario adentrarnos o repasar el mundo de la química orgánica donde el carbono es la figura principal.
El carbono (C) está ubicado en la segunda hilera de la tabla periódica y tiene cuatro electrones de enlace en su envoltura de valencia . Al igual que otros no metales, el carbono necesita ocho electrones para completar su envoltura de valencia .
Por consiguiente, el carbono puede formar hasta cuatro enlaces con otros átomos (cada enlace representa uno de los electrones del carbono y uno de los electrones del átomo que se enlazan).
Cada valencia de electrón participa en el enlace, por consiguiente el enlace del átomo de carbono se distribuirá de modo uniforme sobre la superficie del átomo.
Estos enlaces forman un tetradrón (una pirámide con una punta en la parte superior), como se ilustra en la figura siguiente:
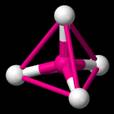
|
| El carbono forma cuatro enlaces. |
La diversidad de los productos químicos orgánicos se debe a la infinidad de opciones que brinda el carbono para enlazarse con otros átomos.
Los químicos orgánicos más simples, llamados hidrocarburos , contienen sólo carbono y átomos de hidrógeno; el hidrocarburo más simple (llamado metano ) contiene un solo átomo de carbono enlazado a cuatro átomos de hidrógeno.
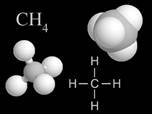
|
| Metano (un átomo de carbono enlazado a cuatro átomos de hidrógeno). |
Pero el carbono también puede enlazarse con otros átomos de carbono adicionalmente al hidrógeno tal como se ilustra en el siguiente dibujo de la molécula
etano (CH
3
—CH
3
):
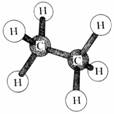
|
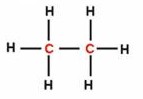
|
| Etano (un enlace carbono-carbono). | |
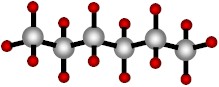
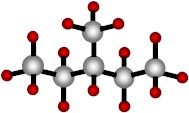
El carbono puede también formar cadenas en rama, como en el hexano y el isohexano:
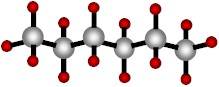
|
| Hexano (una cadena de seis carbonos). |
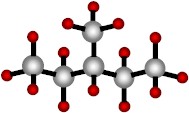
|
| Isohexano (una cadena en ramas de carbono) . |
Puede formar anillos, como en el cyclohexano:
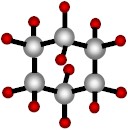
|
| Cyclohexano (un hidrocarburo en forma de anillo). |
Pareciera que no hay límites al número de estructuras diferentes que el carbono puede formar. Para añadirle complejidad a la química orgánica, átomos de carbono vecinos pueden formar enlaces dobles o triples adicionalmente a los enlaces sencillos de carbono-carbono:
|
|
|
| Enlace sencillo | Enlace doble | Enlace triple |
Importante:
Recuerda que cada átomo de carbono puede formar cuatro enlaces. A medida que el número de enlaces entre cualesquiera de dos átomos de carbono aumenta, de uno a dos, tres o cuatro, el número de átomos de hidrógeno en la molécula disminuye, como se grafica en las tres figuras de arriba. Allí vemos enlazados dos carbonos: si el enlace entre ellos es sencillo, necesitan seis hidrógenos para completar su capa de valencia; si el enlace es doble, necesitarán sólo cuatro, y si el enlace es triple, necesitarán sólo dos átomos de hidrógeno.
Hidrocarburos simples
Como ya dijimos, los hidrocarburos simples son compuestos orgánicos que sólo contienen carbono e hidrógeno . Estos hidrocarburos simples vienen en tres variedades (llamadas alcanos, alquenos y alquinos ) dependiendo del tipo de enlace carbono-carbono (sencillo, doble o triple) que ocurre en la molécula.
Alcanos
Los alcanos son la primera clase de hidrocarburos simples y contienen sólo enlaces sencillos de carbono-carbono. Para nombrarlos, se combina un prefijo, que describe el número de los átomos de carbono en la molécula, con la raíz que termina en “ano” .
He aquí los nombres y los prefijos para los primeros diez alcanos.
|
Átomos de
carbono |
Prefijo |
Nombre de alcanos |
Fórmula Química |
Fórmula semidesarrollada |
|
1 |
Meth |
Metano |
CH 4 |
CH 4 |
|
2 |
Eth |
Etano |
C 2 H 6 |
CH 3 CH 3 |
|
3 |
Prop |
Propano |
C 3 H 8 |
CH 3 CH 2 CH 3 |
|
4 |
But |
Butano |
C 4 H 10 |
CH 3 CH 2 CH 2 CH 3 |
|
5 |
Pent |
Pentano |
C 5 H 12 |
CH 3 CH 2 CH 2 CH 2 CH 3 |
|
6 |
Hex |
Hexano |
C 6 H 14 |
CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 |
|
7 |
Hept |
Heptano |
C 7 H 16 |
CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 |
|
8 |
Oct |
Octano |
C 8 H 18 |
CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 |
|
9 |
Non |
Nonano |
C 9 H 20 |
CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 |
|
10 |
Dec |
Decano |
C 10 H 22 |
CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 |
La fórmula química para cualquier alcano se encuentra en la expresión C n H 2n + 2 , donde n es el número de carbonos que se enlazan.
Ejemplo para un alcano que tenga seis carbonos (un hexano):
C n H 2n + 2
Reemplazamos n por el seis y tenemos
C 6 H 2(6) + 2
C 6 H 12 + 2
C 6 H 14
que según su fórmula semidesarrollada es CH 3 CH 2 CH 2 CH 2 CH 2 CH 3
La fórmula semidesarrollada, para los primeros diez alcanos de la tabla, muestra cada átomo de carbono y los elementos a los que están unidos.
Los alcanos simples comparten muchas propiedades en común. Todos entran en reacciones de combustión con el oxígeno para producir dióxido de carbono y agua de vapor. En otras palabras, muchos alcanos son inflamables. Esto los convierte en buenos combustibles. Por ejemplo, el metano es el componente principal del gas natural y el butano es un fluido común más liviano.
Alquenos
La segunda clase de hidrocarburos simples son los alquenos , formados por moléculas que contienen por lo menos un par de carbonos de enlace doble .
|
|
| Eteno, dos carbonos con enlace doble. |
Para nombrarlos, los alquenos siguen la misma convención que la usada por los alcanos . Un prefijo (para describir el número de átomos de carbono) se combina con la terminación “eno” para denominar un alqueno (no puede haber un meteno ya que tendría solo un átomo de carbono). El eteno (que sería el primer alqueno), por ejemplo, consiste de dos moléculas de carbono unidas por un enlace doble .
La fórmula química para los alquenos simples sigue la expresión C n H 2n . Debido a que uno de los pares de carbono está doblemente enlazado, los alquenos simples tienen dos átomos de hidrógeno menos que los alcanos.
Alquinos
|
|
|
Etino, dos carbonos con enlace triple.
|
Los alquinos son la tercera clase de hidrocarburos simples y son moléculas que contienen por lo menos un par de enlaces de carbono, que en este caso será triple. Tal como los alcanos y alquenos, los alquinos se denominan al combinar un prefijo (que indica el número de átomos de carbono) con la terminación “ino” para denotar un enlace triple.
La fórmula química para los alquinos simples sigue la expresión C n H 2n-2 .
Isómeros
Ya que el carbono puede enlazarse de tantas diferentes maneras, una simple molécula puede tener diferentes configuraciones de enlace.
Como ejemplo de tal afirmación, veamos las dos moléculas siguientes:
|
CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 |
|
|||||||||
| C 6 H 14 | C 6 H 14 | |||||||||
Ambas moléculas tienen formulas químicas idénticas ( C 6 H 14 ), sin embargo sus fórmulas desarrolladas y estructurales (y, por consiguiente, algunas propiedades químicas) son diferentes. Estas dos moléculas son llamadas isómeros .
Los isómeros son moléculas que tienen la misma fórmula química , pero diferentes fórmulas desarrolladas y estructurales .
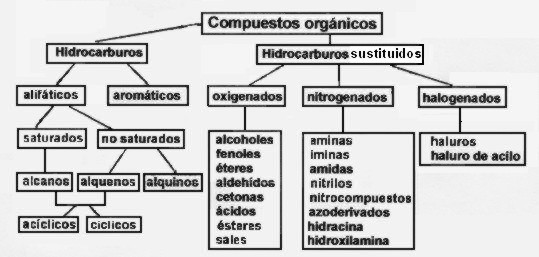
Clasificación de los compuestos orgánicos
Como ya dijimos, los hidrocarburos, formados solo por carbono e hidrógeno, son los compuestos orgánicos más simples en su composición, por ello es que se pueden tomar como base para hacer una clasificación de los compuestos orgánicos.
Si en un hidrocarburo sustituimos uno o más átomos de hidrógeno por otro átomo o agrupación de átomos podemos generar todos los tipos de compuestos orgánicos conocidos. Por ejemplo, si en un alcano (hidrocarburo saturado) sustituimos un átomo de hidrógeno por un halógeno obtendremos un derivado halogenado, y si en un alcano sustituimos dos átomos de hidrógeno por uno de oxígeno podemos general un aldehído (si la sustitución ocurre en un átomo de carbono terminal) o una cetona (si la sustitución se hace en un carbono intermedio).
Entendido esto, podemos clasificar los compuestos orgánicos en hidrocarburos e hidrocarburos sustituidos .
|
Si la sustitución de átomos de hidrógeno en los hidrocarburos se hace con átomos de oxígeno, hablaremos de
compuestos oxigenados
o
funciones oxigenadas
(alcoholes, fenoles, éteres, aldehídos, cetonas, ácidos, ésteres, sales).
Si la sustitución de átomos de hidrógeno en los hidrocarburos se hace con átomos de nitrógeno, hablaremos de compuestos nitrogenados o funciones nitrogenadas .
¿Qué es un grupo funcional?
Hemos visto que los hidrógenos de los hidrocarburos pueden ser sustituidos por átomos de otro metal o por un agrupamiento de átomos para obtener compuestos derivados que poseen propiedades muy diferentes y que presentan estructuras muy distintas (el átomo o grupo de átomos sustituyentes les confieren otras propiedades físicas y químicas).
Pues bien, a ese átomo o grupo de átomos que representan la diferencia entre un hidrocarburo y el nuevo compuesto, se le llama grupo funcional .
Como corolario, podemos decir que un grupo funcional es un átomo o grupo de átomos que caracteriza a una clase de compuestos orgánicos.
Cada grupo funcional determina las propiedades químicas de las sustancias que lo poseen; es decir determina su función química .
Entonces, se llama función química a las propiedades comunes que caracterizan a un grupo de sustancias que tienen estructura semejante; es decir, que poseen un determinado grupo funcional.
|
| Etanol |
Por ejemplo, en un alcano , los átomos de hidrógeno pueden ser sustituidos por otros átomos (de oxígeno o nitrógeno, por ejemplo), siempre que se respete el número correcto de enlaces químicos (recordemos que el oxígeno forma dos enlaces con los otros átomos y el nitrógeno forma tres). El grupo OH en el alcohol etílico y el grupo NH 2 en la etilamina son grupos funcionales .
Reiteramos: La existencia de un grupo funcional cambia completamente las propiedades químicas (la función química ) de la molécula. A título de ejemplo, el etano, alcano con dos carbonos, es un gas a temperatura ambiente; el etanol, el alcohol de dos carbonos (derivado del etano por sustitución), es un líquido.
El etanol, el alcohol que se bebe comúnmente, es el ingrediente activo en las bebidas "alcohólicas" como la cerveza y el vino.
Los principales grupos funcionales son los siguientes:
Grupo hidroxilo (– OH)
Es característico de los alcoholes, compuestos constituidos por la unión de dicho grupo a un hidrocarburo (enlace sencillo).
Grupo alcoxi (R – O – R)
Grupo funcional del tipo R-O-R', en donde R y R' son grupos que contienen átomos de carbono, estando el átomo de oxígeno en medio de ellos, característico de los éteres (enlace sencillo). (Se usa la R ya que estos grupos de átomos constituyen los llamados radicales )
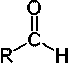
Grupo carbonilo (>C=O)
Su presencia en una cadena hidrocarbonada (R) puede dar lugar a dos tipos diferentes de sustancias orgánicas: los aldehídos y las cetonas .
En los aldehídos el grupo C=O está unido por un lado a un carbono terminal de una cadena hidrocarbonada (R) y por el otro, a un átomo de hidrógeno que ocupa una posición extrema en la cadena. (R–C=O–H) (enlace doble).
En las cetonas , por el contrario, el grupo carbonilo se une a dos cadenas hidrocarbonadas, ocupando por tanto una situación intermedia. (R–C=O–R) (enlace doble).
Ver: PSU: Química; Pregunta 05_2005(Química2)
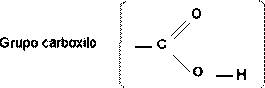
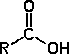
Es el grupo funcional característico de los ácidos orgánicos .
Los ácidos orgánicos reaccionan con los alcoholes de una forma semejante a como lo hacen los ácidos inorgánicos con las bases en las reacciones de neutralización. En este caso la reacción se denomina esterificación , y el producto análogo a la sal inorgánico recibe el nombre genérico de éster .
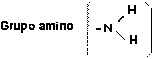
Puede considerarse como un grupo derivado del amoníaco (NH 3 ) y es el grupo funcional característico de una familia de compuestos orgánicos llamados aminas .
Funciones oxigenadas
A continuación, un cuadro resumen de los grupos funcionales (con su correspondiente función química) donde participan átomos de carbono, hidrógeno y oxígeno.
Presencia de algún enlace carbono-oxígeno : sencillo (C-O) o doble (C=O)
| Grupo funcional |
Función o compuesto |
Fórmula |
Estructura |
Prefijo |
Sufijo |
|
Grupo hidroxilo |
Alcohol |
R-OH |
hidroxi- |
-ol |
|
|
Grupo alcoxi (o ariloxi) |
Éter |
R-O-R' |
-oxi- |
R -il R' -il éter |
|
|
Grupo carbonilo |
Aldehído |
R-C(=O)H |
|
oxo- |
-al
|
|
Cetona |
R-C(=O)-R' |
oxo- |
-ona |
||
|
Grupo carboxilo |
Ácido carboxílico |
R-COOH |
carboxi- |
Ácido -ico |
|
|
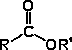
Grupo acilo |
Éster |
R-COO-R' |
-iloxicarbonil- |
R -ato de R' -ilo |
Importante:
Nótese que en las funciones alcohol y éter hay sólo enlaces sencillos (de la forma C – O), en cambio en todas las otras funciones oxigenadas hay enlaces dobles (de la forma C = O). Este aspecto es muy importante para definir el número de átomos de hidrógeno que tiene algún compuesto químico. (Ver: PSU: Química, Pregunta 08_2005 ) .
Funciones nitrogenadas
A continuación, un cuadro resumen de los grupos funcionales (con su correspondiente función) donde participan átomos de carbono, hidrógeno y nitrógeno.
Presencia de enlaces carbono-nitrógeno , simples (C – N), dobles (C = N) o triples (C ≡ N)
| Grupo funcional |
Función o compuesto |
Fórmula |
Estructura |
Prefijo |
Sufijo |
|
Grupo amino |
Amina |
R-NR 2 |
amino- |
-amina |
|
|
Imina |
R-NCR 2 |
_ |
_ |
||
|
Grupos amino
|
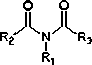
Amida |
R-C(=O)N(-R')-R" |
_ |
_ |
|
|
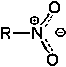
Grupo nitro Nitrocompuesto |
R-NO 2 |
|
nitro- |
||
|
Grupo nitrilo |
Nitrilo o cianuro |
R-CN |
ciano- |
-nitrilo |
|
|
Isocianuro |
R-NC |
alqu il isocianuro |
_ |
||
|
Isocianato |
R-NCO |
alqu il isocianato |
_ |
||
|
Grupo azo |
Azoderivado |
R-N=N-R' |
azo- |
-diazeno |
|
|
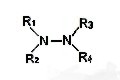
_ |
Hidrazina |
R1R2N-NR3R4 |
_ |
-hidrazina |
|
|
_ |
Hidroxilamina |
-NOH |
_ |
-hidroxilamina |
Funciones halogenadas
A continuación, un cuadro resumen de los grupos funcionales donde participan átomos de carbono, hidrógeno y elementos halógenos.
Compuestos por carbono, hidrógeno y halógenos.
|
Grupo funcional |
Tipo de compuesto |
Fórmula del
|
Prefijo |
Sufijo |
|
Grupo haluro |
Haluro |
R-X |
halo- |
_ |
|
Grupo acilo |
Haluro de ácido |
R-COX |
Haloformil- |
Haluro de -oílo |
Ver: Funciones químicas
Fuentes Internet:
http://www.visionlearning.com/library/module_viewer.php?mid=60&l=s
http://www.scribd.com/doc/9344616/Grupos-Funcionales-1
http://es.wikipedia.org/wiki/Enlace_carbono-ox%C3%ADgeno